CAP认证-美国临床实验室的管理思路以及几个认证之间的关系
先回顾一下美国临床实验室的管理思路以及几个认证之间的关系,清楚这一部分的朋友可自行跳过
CLIA:临床实验室改进修正案
为规范临床检测提供者和临床检测试剂盒的质量管理体系,美国颁布《临床实验室改进修正案》(Clinical Laboratory Improvement Amendments,简称CLIA),对临床检测的质量管理程序提出了指导意见。
临床实验室改进修正案 (CLIA) 规范实验室测试,并要求临床实验室在接受人体样本进行诊断测试之前,必须获得医疗保险和医疗补助服务中心 (CMS) 的认证。
三个联邦机构负责 CLIA:食品和药物管理局 (FDA)、医疗补助服务中心 (CMS) 和疾病控制与预防中心 (CDC)。每个机构在确保实验室检测质量方面都发挥着独特的作用。具体如下图所示:

获CLIA是美国联邦政府的临床实验室执照,是强制实施的质量管理体系,所有美国的临床检验实验室都必须执行。所有临床检验实验室必须在CLIA法规下开展检验项目,必须拥有CLIA证书。
CAP与CLIA的关系
CAP是独立的实验室认证体系。CAP作为政府的代理机构,其职责是确保CLIA的规章制度被严格执行,同时它还可以自主判断并增加更多的它认为必要的规定,来帮助临床检验实验室取得最好的质量和表现。
自 1946 年以来,随着医学、技术和病理学的不断发展,CAP 引领着迎接新挑战的道路,从而带来更好的患者结果。75 年来,CAP 培养了卓越的实验室并推动了病理学和实验室科学的实践。
在CLIA基础上,美国病理学会(College of American Pathologists,简称CAP)凭借病理学在疾病诊断中无法动摇的金标准地位,对CLIA提出了自己的解读,制定了具有可操作性的质量评价规程和认证体系(后面会通过checklist展示其可操作性)。
所以对比下来,CLIA是政府法规,CAP是行业标准,二者地位不同;CLIA是强制执行,CAP是可选项,申请二者的难易程度不同;CLIA是核心条款,CAP既包括全部CLIA条款,又在细节上进行了丰富,二者详略不同;另外,CAP可以取代CLIA的两年一次的重审,但是不能取代CLIA的初审。
CAP与ISO15189的关系
ISO 15189 的认可标准由国际标准化组织第 212 技术委员会(1995 年成立的制订医学实验室认可国际标准的专门委员会,该委员会为 ISO 所接受并被命名为 TC 212)制定,主要用于无正式认可计划的国家,以及国际化的认可活动。最初由美国克里夫兰医院的 Dr. Thomas Gavan 起草,其基于临床和实验室标准研究所(CLSI)的标准和 CAP 认可计划的核查表,去掉美国 CLIA 的专门要求,增加了 ISO 导则 25(现在的 ISO17025)的要求,同时结合了 ISO 的其他有关的标准和 ISO 9001 体系而制定,于 2003 年颁布执行。ISO 15189 于 2007 已经转化为我国的国家标准 GB/T22576-2008《医学实验室质量和能力的专用要求》,现行版本为GB/T 22576.1-2018。
ISO15189分为管理和技术要求两部分
管理要求: 包含组织和管理、质量管理体系、文件控制、合同评审、委托实验室检验、外部服务和供应、咨询服务、投诉的解决、不符合的识别和控制、纠正措施、预防措施、持续改进、质量和技术记录、内部审核和管理评审 15 个要素;
技术要求 :包含人员、设施和环境条件、实验室的设备、检验前程序、检验程序、检验程序的质量保证、检验后程序和结果报告 8 个要素。
由于ISO15189的标准使用国际通用术语,标准要求尽可能适用于不同国家的医学实验室,所以较少规定性的东西,强调运作系统的改进、风险控制以及质量管理。ISO15189通过实施标准流程和故障分析来改进工作流程;通过实施自动化来控制过程偏差、减少浪费,从而提高效率,节省成本。
而CAP 实验室认可计划特别为美国的医学实验室量身定做,包含一些美国的法律法规要求,特别对人员资质和安全方面有其特殊要求。CAP核查表是 CAP 认可文件的核心部分,是实践标准的重要指南。它既是任何已认可或准备认可实验室的实施指南,同时也是检察官对任何实验室现场评审的检查指南。因此,对 CAP 标准中技术细节的实施和检查的共识度高,结果的一致性较好。
CAP LAP:实验室认可计划有 4 个标准
标准 I 与人员资质、责任和实验室主任的职责有关;
标准 Ⅱ 是对有关实验室的物理设施和安全,包括空间、仪器设备、家具、联络工具、实验室空气流通、公共用具和安全设施等的要求;
标准 Ⅲ 是对质量的要求,包括质量控制、能力验证(PT)、仪器维护、质量管理和持续改进等;
标准 IV 是检查的要求,包括外部组织的现场检查和内部的自我检查。
对标准的进一步细化 CAP 实验室认可计划提供了其核心文件——认可核查清单,它以问题的形式表示,约有 3000 多条问题,覆盖了认可标准要求的方方面面,是实践标准的指南。
CAP LAP 认可核查清单的 「实验室一般要求」,是对整个实验室和各专业的基本要求,包括:能力验证、质量管理、质量控制、标本和报告、对实验用水和玻璃器皿洗涤的要求、方法性能验证、人员要求、实验室计算机和信息系统的功能、实验室安全和实验室环境设施等的各项要求。
除此之外,还有针对不同专业的核查清单,如:化学和毒物学、血液学和凝血、微生物学、分子生物学、输血学、尿液分析和临床镜检等的核查清单。
接来下我们步入正题,先来看看CAP检查表:

法宝一 ——CAP检查表解析
所有CAP检查表需求都包含一个需求编号、主题标题、阶段和一个声明性声明。
一些要求还包括对需求的解释和/或合规证据。
检查表的主版本还包含参考资料和检查员(阅读、观察、询问、发现)说明,可为合规性评估提供有价值的见解。

就如上图所示,每一个部分开头先概述要求;之后会对审核员阅读哪些东西、观察哪些细节、询问哪些问题以及发现哪些证据都有详细的讲述。再回想下我们的内审检查表,是不是有可以借鉴的地方?
接下来会一条一条的讲解:比如针对LDT项目的验证环节,编号为“MOL.31130”,主题是“检测性能的验证”,
先提出验证的范围:
● 分析精度
● 分析精密度/再现性
● 可报告范围
● 分析灵敏度(检测下限)
● 分析特异性
● 确保分析测试性能所需的任何其他性能特征(例如,试样稳定性、试剂稳定性、线性、携带量和交叉污染)
之后,对每一条进行注释,大概如下:
注2:通过将结果与确定方法、参考方法或已建立的比较方法进行比较,验证准确性。对于定量测试,准确度指的是“接近真实值”,而对于定性测试,准确度指的是与比较测试或用于确定“真实值”的测试的相关性。……
对于实验室开发的试验,证明分析准确度的适当数量的样品定义如下:
● 对于定量试验,应使用至少20个分析物浓度分布在整个分析测量范围内的样品。按比例混合的样本可用于补充研究人群。
● 对于定性测试,应使用至少20个样本,包括阳性、阴性,以及(在适当情况下)浓度接近较低检测水平的低阳性样本;不应使用模棱两可的样本
具体到至少多少个样本,真是详细到令人发指的程度了。
这还没完,还告诉你可以准备哪些证据:
✓ 验证试验方法和性能规范的书面程序
✓ 试验方法性能规范各组成部分的验证研究和书面评估记录
还还告诉你,可以参考哪些资料:

法宝二 ——PT
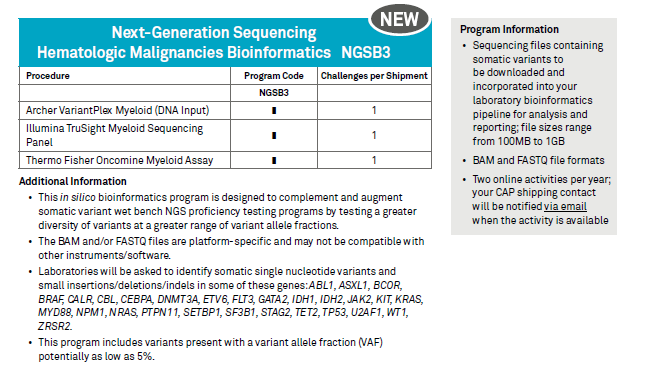
CAP认证的第二个法宝就是丰富且经常更新的能力验证 (Proficiency Testing, PT) 评估项目。

简单举个二代测序今年更新的例子:
最后,再现几个跟审核老师的对话,侧面感受一下他们对CAP的认知观。
问:老师,您实验室申请CAP认证是出发点是什么?
答:美国这边的实验室,申请CAP主要是提升自身检测能力的,不会用来做宣传,发公号朋友圈……
问:老师,我们实验室现在还没通过认证,为什么有一条不符合是未张贴CAP标识?不涉及虚假宣传么?
答:张贴CAP标识不是用来宣传,而是一种监督,告知全体实验室人员你们在按照CAP的要求开展检验业务,如果存在违背CAP的情况,他们有权向总部揭发检举……
问:在美国已有FDA批准的产品,还能LDT否?
答:当然可以,美国FDA批准的产品,有时候实验室测出来效果不好,仍然会自主开发更能符合实验需求的LDT产品,这是法规允许的……
 关键字
关键字
 联系方式
联系方式

 {{ articleInfo.phone }}
{{ articleInfo.phone }}
 {{ articleInfo.email }}
{{ articleInfo.email }}
 深圳市龙岗区平湖街道平安大道1号华耀城12栋605
深圳市龙岗区平湖街道平安大道1号华耀城12栋605













 18576401396
18576401396